《分析物质变化中的能量变化》测试
1、单选题
1.下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba2反应的反应热 △H = 2× kJ/mol
B.CO的燃烧热283.0 kJ/mol,则反应 2CO+O2 =2CO2的△H= -2×283.0 kJ/mol
C.需要加热才能发生的反应肯定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
2.如图所示,有关化学反应和能量变化的说法正确的是( )
a.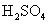 b.
b.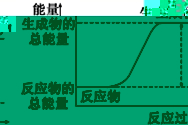
A.图a表示的是吸热反应的能量变化
B.图a无需加热就能发生,图b肯定需要加热才能发生
C.图a可以表示C与CO2反应生成CO的能量变化
D.图b中反应物比生成物稳定
3.下列是吸热反应的是
A.![]() B.Na与水反应
B.Na与水反应
C.![]() 燃烧 D.酸碱中和
燃烧 D.酸碱中和
4.下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
A.![]() H2+
H2+![]() Cl2===HCl ΔH=-184.6 kJ·mol-1
Cl2===HCl ΔH=-184.6 kJ·mol-1
B.CH4+2O2===2H2O+CO2 ΔH=-802 kJ·mol-1
C.CO+![]() O2===CO2 ΔH=-283 kJ·mol-1
O2===CO2 ΔH=-283 kJ·mol-1
D.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1
5.依据热化学方程式(在101 kPa时):S+O2= SO2ΔH=-297.23kJ/mol,剖析下列说法中错误的是
A.S的燃烧热为297.23 kJ/mol
B.形成1 mol SO2的化学键所释放的总能量大于断裂1mol S和1mol O2的化学键所吸收的总能量
C.S+O2 = SO2放出的热量小于297.23 kJ
D.1mol SO2的总能量小于 1mol S和1mol O2的总能量
6.下列化学用语的有关表述中正确的是
A.因H+ +OH- = H2O △H=-akJ·mol-1,故1molNaOH 固体与足量的稀盐酸反应,放出的热量为akJ
B.因CuSO4·5H2O= CuSO4+5H2O △H= +b kJ·mol-1,故1mol CuSO4溶于水时,放出的热量为bkJ
C.因氢气的燃烧热为c kJ·mol-1,故水电解的热化学方程式为2H2O = 2H2+O2 △H=+c kJ·mol-1
D.因N2+ 3H2![]() 2NH3 △H=-d kJ·mol-1,故在某容器中通入1molN2 与3molH2充分反应后,放出的热量小于dkJ
2NH3 △H=-d kJ·mol-1,故在某容器中通入1molN2 与3molH2充分反应后,放出的热量小于dkJ
7.有关化学反应原理的说法正确的是
A.对任何化学反应来讲,反应速率越大,反应现象就越明显
B.反应物的热效应与是不是用催化剂无关
C.已知中和热![]()
![]() ,则1mol浓
,则1mol浓![]() 和1mol
和1mol ![]() 的反应热
的反应热![]()
D.向![]() 溶液中通入少量HCl气体,溶液的导电性明显增强
溶液中通入少量HCl气体,溶液的导电性明显增强
8.高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要用途是在反应过程中只让Li+通过。结构如图所示。
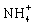
原理如下:LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是( )
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向右移动,若转移1mole-,石墨电极将增重7x克
9.![]() 催化
催化![]() 还原
还原![]() 的机理示意图如下。下列说法不正确的是( )
的机理示意图如下。下列说法不正确的是( )
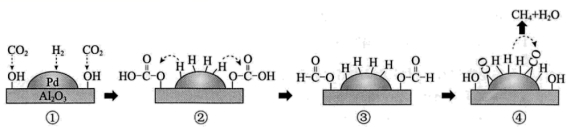
A.![]() 的断裂需要吸收能量 B.①→②,
的断裂需要吸收能量 B.①→②,![]() 发生加成反应
发生加成反应
C.④中,![]() 被氧化为
被氧化为![]() D.生成
D.生成![]() 总反应的化学方程式是
总反应的化学方程式是
10.反应 H2+Cl2 → 2HCl的能量变化可用下图表示。下列说法错误的是
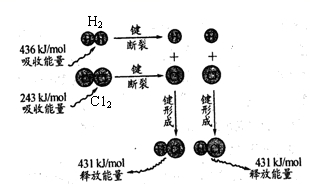
A.2 mol 气态氢原子的能量低于1 mol 氢
B.氢气分子中的化学键比氯气分子中的化学键更稳定
C.氢气与氯气反应的热化学方程式为 H2+Cl2 → 2HCl +183 kJ
D.该反应在光照和点燃条件下的反应热效应是相同的
11.关于化学反应与能量的说法正确的是
A.化学键断裂需要吸收能量
B.化学反应中能量变化的大小与反应物的水平多少无关
C.在化学反应过程中反应物的总能量一直等于生成物的总能量
D.吸热反应需要在加热的条件下才能进行
12.依据下列图示所得出的结论正确的是
A.图甲表示压强对可逆反应2A+2B![]() 3C+D的影响,乙的压强比甲的压强大
3C+D的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示肯定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的实际转化的比例大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
13.将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
14.有X、Y、M、N四种金属。X、Y与电解质溶液构成原电池时,电子从X极流出。将Y、M与电解质溶液构成原电池时,M电极为正极。将形状、大小均相同的X、N分别投入等浓度的稀硫酸中;N比X反应剧烈。据此判断它们的活动性由强到弱的顺序是
A.NXYM B.NMXY C.NYXM D.YXNM
15.下列热化学方程式或离子方程式正确的是
A.已知H2的规范燃烧热ΔH=-285.8 kJ·mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)===H2O(g)ΔH=-285.8 kJ·mol-1
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-![]() NH3↑+2H2
NH3↑+2H2![]() O
O
D.用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+
2、填空题
16.写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式___________________。
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________。
(4)红磷P和Cl2发生反应生成PCl3和PCl5。反应过程和能量关系如图所示。
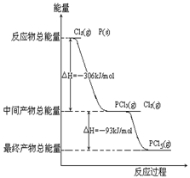
①P和Cl2反应生成PCl3的热化学方程式______________________。
②PCl5分解成PCl3和Cl2的热化学方程式_______________________。
17.已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2和O2生成NO过程中的能量变化:
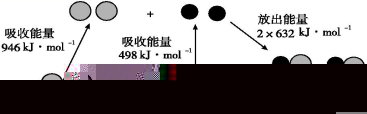
(1)大家一般把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为_________________kJ·mol-1。依据上图写出N2和O2生成NO的热化学方程式:________________________________。
(2)NO分解生成N2和O2的热化学方程式为:_____________________。当有16 g O2生成时,该反应中放出的热量为:_________________kJ。
18.Ⅰ.拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要吸收的能量分别为436 kJ、391 kJ、946 kJ。则1 mol N2生成NH3_____________kJ热量;
Ⅱ.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是CH4-8e-+10OH-=CO![]() +7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
+7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
通入CH4的电极为________极,发生________反应。
该燃料电池的总反应式为_________。
若将该电池中的燃料改为氢气,请写出此时正、负极的反应式:正极_________,负极________。
19.(1)在化学反应中使普通分子变成活化分子所需提供的最低能量叫活化能,察看如图,然后回答问题。
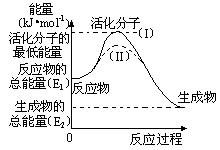
①图中反应是___(填“吸热”或“放热”),该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2+![]() O2=H2O △H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能为___。
O2=H2O △H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能为___。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生很多氮气和水蒸气,并放出很多的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.0kJ的热量。
①反应的热化学方程式为___。
②又已知H2O=H2O;ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___kJ。
③此反应用于火箭推进,除释放很多热和迅速产生很多气体外,还有一个非常大的优点是___。
20.依据事实,写出下列反应的热化学方程式。
1 mol N2与适当H2反应,生成2 mol NH3,放出92.4 kJ热量 _______。
1 mol Cu与适当O2反应,生成CuO,放出157 kJ热量_______。
23 g C2H6O和适量的氧气混合点燃,恰好完全反应,生成CO2和H2O,放出683.5 kJ的热量_______。
3、元素或物质判断题
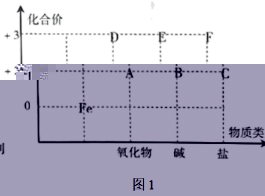
21.从化合价和物质类别两个视角认识元素及其化合物性质是要紧的化学学习技巧。图1是Fe及其化合物的化合价~物质类别二维图。
回答下列问题:
(1)工业上冶炼Fe常见的办法是______(填选项字母)。
a.电解法b.还原法c.热分解法d.物理办法
(2)若图1中的F为硫酸盐,请写出由D生成F的离子方程式______。
(3)图1中的B在潮湿的空气中比较容易发生化合反应变成E,该反应的化学方程式为______。
(4)图1中的F与C在水溶液中的转化离子反应有:2Fe3++2I-⇌2Fe2++I2。为了探究该反应存在肯定的限度,某化学兴趣小组在试管中取10mL0.5mol/L的KI溶液,再加入10mL0.2mol/L的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的______(填选项字母)。
A.淀粉溶液 B.KSCN溶液 C.CCl4 D.酸性高锰酸钾溶液
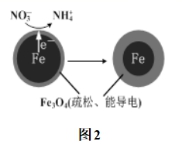
(5)用![]() 可以去除水体中的
可以去除水体中的![]() (原理如图2)。若有1mol
(原理如图2)。若有1mol![]() 转化为
转化为![]() ,则参加反应的
,则参加反应的![]() 失去的电子的物质的量为______mol。
失去的电子的物质的量为______mol。
(6)某化学兴趣小组借助原电池原理(如图所示)探究Fe3+的氧化性强于Cu2+。
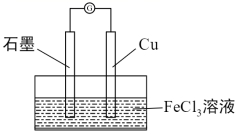
写出该装置的电极反应式。负极:______;正极:______。
4、实验题
22.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
上述实验中发生反应的化学方程式有___________。
要加快上述实验中气体产生的速率,还可采取的手段有_______________。
为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量锌粒的反应瓶中,采集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4 | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O | V7 | V8 | V9 | V10 | 10 | 0 |
其中:V1=________,V6=________,V9=________。
23.如图为测定中和热的实验装置图。请回答下列问题:
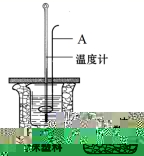
①仪器A的名字为___;
②假如用0.50mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将___
最近发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具备参与调节神经信号传递、舒张血管减轻高血压的功能。如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

①依据如图,请写出系统中制氢的热化学方程式___;
②系统和系统相比,制得等量H2所需能量较少的是__(填“I”或“II”)。
5、计算题
24.“西气东输”是国内开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,二者的体积比为1:
1。已知1 molCO气体完全燃烧生成CO2气体放出282. 6kJ热量; 1mol氢气完全燃烧生成液态水放出285. 8kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出889. 6kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学方程式: _________ 。
(2)若1molCH4 气体完全燃烧生成CO2气体和水蒸气, 放出的热量______889. 6kJ。
(3)忽视水煤气中其他成分,相同情况下若得到相等的热量,所需水煤气与甲烷的体积比约为________。
25.碳是形成化合物类型最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
已知CH3OH的燃烧热为726.51kJ/mol,CH3OH + 1/2O2=CO2 + 2H2O ΔH=-a kJ/mol,则a______(填“>”“<”或“=”)726.51。
使Cl2和H2O通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式___________________。
火箭和导弹表面的薄层是耐高温的物质。将石墨、铝粉和二氧化钛按肯定比率混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为:4Al + 3TiO2 + 3C=2Al2O3 + 3TiC ΔH=-1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为__________。
参考答案
1.B 2.D 3.A 4.C 5.C 6.D 7.B 8.D 9.C 10.A 11.A 12.B 13.A 14.A 15.D
16.B2H6 + 3O2 = B2O3 + 3H2O △H= —2165kJ/mol CH4 + 2O2 = CO2 + 2H2O △H= —890kJ/mol N2 + 3H2 = 2NH3 △H= kJ/mol P + 3/2Cl2 = PCl3 △H= —306kJ/mol PCl5 = PCl3 + Cl2 △H= +93kJ/mol
17.946N2+O2![]() 2NOΔH=180 kJ·mol-12NO
2NOΔH=180 kJ·mol-12NO![]() N2+O2ΔH=—180 kJ·mol-190
N2+O2ΔH=—180 kJ·mol-190
18.放出 92 负 氧化 CH4+2O2+2OH-=CO![]() +3H2O O2+4e-+2H2O=4OH- 2H2-4e-+4OH-=4H2O
+3H2O O2+4e-+2H2O=4OH- 2H2-4e-+4OH-=4H2O
19.放热 E2-E1 409.0kJ/mol N2H4+2H2O2=N2+4H2O △H=-640kJ/mol 408kJ 产物为氮气和水,清洗无污染
20.N2+3H2![]() 2NH3 ΔH=-92.4 kJ·mol-1Cu+1/2O2=CuO ΔH=-157 kJ·mol-1C2H6O+3O2=2CO2+3H2O ΔH=-1 367 kJ·mol-1
2NH3 ΔH=-92.4 kJ·mol-1Cu+1/2O2=CuO ΔH=-157 kJ·mol-1C2H6O+3O2=2CO2+3H2O ΔH=-1 367 kJ·mol-1
21.b Fe2O3+6H+=2Fe3++3H2O 4Fe2+O2+2H2O=4Fe3 B 8 Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+(或Fe3++e-=Fe2+)
22.Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=Cu+ZnSO4 适合加热、适合增大硫酸浓度、将锌粒换成锌粉 30 10 17.5
23.环形玻璃搅拌棒 偏大 H2S=H2+S △H=+20kJ/mol II
24. 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol 小于 3:1
25.< 2Cl2+2H2O+C=4HCl+CO2 △H=-290kJ•mol-1 98kJ







